

Camille Laurent
Tropilaelaps spp. a franchi les portes de l’Europe en 2021, par les Balkans
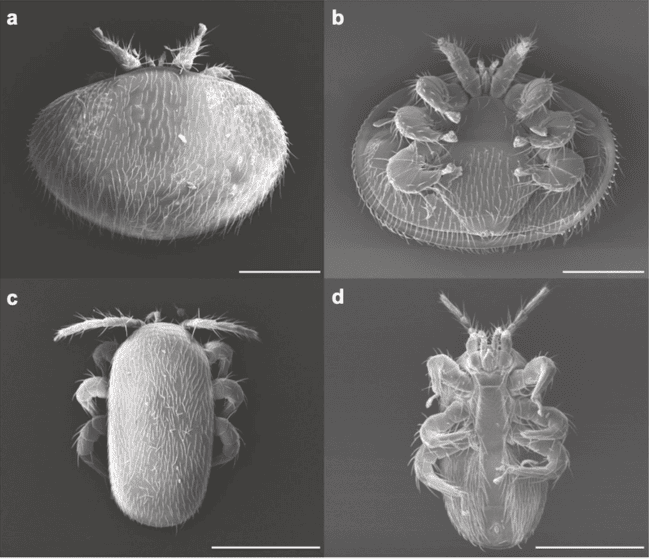
Des études récentes et alarmantes confirment la progression, aux portes de l’Europe de l’Est, de l’acarien parasite de l’abeille Tropilaelaps spp.(1), et plus précisément Tropilaelaps mercedesae (Brandorf & al., 2024 ; Janashia & al., 2024). Ce parasite de l’abeille, proche du varroa, tant sur le comportement que sur l’anatomie (photo 1), se cantonnait jusqu’à présent en Asie.
Par Camille Laurent, ingénieure agronome(2)
L’acarien Tropilaelaps spp. est considéré, par de nombreuses études, comme une menace très inquiétante, voire plus importante que Varroa destructor, car il transmet les mêmes maladies virales, blesse les larves en de plus nombreux sites et son taux de reproduction est plus élevé et plus rapide (Burgett & al. 1983, Ritter and Schneider-Ritter, 1988 ; Buawangpong & al. 2015, Han & al., 2024).
Histoire et répartition géographique actuelle
C’est la docteure Mercedes Delfinado qui décrit en 1961 pour la première fois l’espèce clareae, du genre Tropilaelaps. Il est découvert dans des ruchers d’Apis mellifera, aux Philippines dans les années 60 (Michael, 1962). Le parasitisme est alors partagé avec le varroa dans ces mêmes ruches.
L’hôte naturel de Tropilaelaps serait, entre autres, Apis dorsata (Laigo & Morse, 1968). La colonie essaime deux fois par an et est connue pour parcourir de longues distances. Cette spécificité conduit à des interruptions régulières de couvain et donc à une sensibilité plus faible à l’infestation par l’acarien Tropilaelaps. Il existe des aires de cohabitation entre A. dorsata et les deux autres espèces domestiquées A. mellifera et A. cerana (illustration 2).
Comme pour le varroa, l’introduction d’A. mellifera en Asie a permis des changements d’hôtes réussis pour le genre Tropilaelaps (de Guzman & al., 2017). L’acarien est trouvé sur presque 100 % des rayons d’A. dorsata, et cette dernière aurait été observée en train de piller les ruches d’A. mellifera ce qui pourrait expliquer la contamination entre les hôtes (Laigo & Morse, 1968). Depuis son foyer philippin, le parasite n’a cessé de s’étendre selon la biogéographie de son hôte naturel (Anderson & Morgan, 2007). Tropilaelaps aurait gagné les régions occidentales par la Serbie où il aurait été observé pour la première fois en avril-mai 1981 sur des bourdons et des abeilles. Cette infestation massive par un parasite jusqu’alors inconnu a été détectée (Manić & al., 2014), mais n’a pas été officiellement diagnostiquée. Au Monténégro, l’acarien Tropilaelaps n’est pas présent en 2019 (Rašović, 2019). Il l’est en Ouzbékistan en 2013 (Anderson and Roberts, 2013). Enfin, plus récemment, en 2021 des pertes importantes de colonies d’abeilles mellifères ont eu lieu dans la région de Krasnodar, en Russie occidentale, avec des symptômes cliniques et une morphologie des acariens permettant d’avérer des infestations par Tropilaelaps spp. (Brandorf & al., 2024). Dernièrement, c’est en Géorgie que l’acarien a été détecté (Janashia & al., 2024). Officiellement, le parasite a franchi les portes de l’Europe par les Balkans en 2021, mais sa présence pourrait être antérieure d’une trentaine d’années. Il est de nouveau détecté en Russie centrale, au nord du Kazakhstan (région de Tioumen), en juillet 2024 (Joharchi & Stolbova, 2024).
Quatre espèces de Tropilaelaps sont connues à l’heure actuelle :
- T. clareae (Delfinado & Baker, 1961) parasite A. dorsata, A. mellifera, mais aussi A. cerana, A. laboriosa et A. florea (Anderson & Morgan, 2007),
- T. koenigerum (Delfinado-Baker & Baker, 1982) se cantonne à A. dorsata au Sri Lanka, Asie continentale et Indonésie.
- T. mercedesae (Anderson & Morgan, 2007), longtemps confondu comme un haplotype de T. clareae, parasite A. mellifera et A. dorsata dans toute l’Asie continentale et en Indonésie (à l’exception de l’île de Sulawesi)
- T. thaii (Anderson & Morgan, 2007) n’a été trouvé que sur A. laboriosa au Vietnam, mais il est probable qu’il soit présent sur d’autres populations d’A. laboriosa.
Des quatre espèces, seules T. mercedesae et T. clareae se reproduisent dans le couvain d’A. mellifera. De ces deux espèces, T. mercedesae est la plus répandue, bien au-delà de l’aire géographique de l’hôte d’origine. C’est l’espèce qui menace l’Europe (Anderson & Morgan, 2007). Anatomie comparée avec le varroa L’acarien Tropilaelaps est visible à l’oeil nu tout comme le varroa. Son corps est plus long que large, ce qui lui permet une grande mobilité sur les rayons de miel et entre les poils du corps de l’abeille (illustration 3). Il court littéralement sur le cadre, contrairement au varroa, qui a un corps plus large que long, et qui se déplace plus lentement (Burgett & al., 1983). Cette morphologie caractéristique lui confère aussi la capacité à s’insérer plus facilement entre les segments des abeilles. Il serait de ce fait mieux protégé de l’épouillage et de l’auto-toilettage des abeilles (Koeniger & Muzaffar, 1988). Les faux-bourdons ne pratiquant pas, ou moins, le toilettage, les mâles à la dérive participent à la dispersion des parasites (Rath & al., 1991). Chez son hôte adapté, A. mellifera, les acariens Tropilaelaps semblent préférer le couvain de faux-bourdons à celui des ouvrières (Woyke, 1987d, Ritter & Schneider-Ritter, 1988 ; Pettis et al., 2013). En revanche, aucune préférence entre les ouvrières et les faux-bourdons n’a été décrite lors du parasitisme de son hôte indigène, A. dorsata (Buawangpong et al., 2015). Cette différence de préférence serait due au regroupement du couvain de faux-bourdons chez A. mellifera, alors que le couvain de faux-bourdons est dispersé de manière aléatoire dans les colonies d’A. dorsata (Burgett et al., 1990). Une des grandes différences avec le varroa est l’anatomie de ses pièces buccales (illustration 4). Les chélicères du tropilaelaps sont faites pour déchirer des membranes souples et non percer des cuticules dures (Griffiths, 1988 ; Koeniger & Muzaffar, 1988). Ce qui représente la principale raison de sa phase phorétique très courte. C’est un acarien presque exclusivement du couvain, car il ne peut se nourrir que sur les larves ou les pupes (Pettis & al., 2013). Cependant, sa capacité à s’insérer entre les segments des abeilles lui permettrait quand même d’atteindre aussi les quelques membranes molles de l’ouvrière adulte, notamment autour des articulations comme le cou et des axillaires des ailes où il a déjà été observé en train de sucer l’hémolymphe (Anderson & Morgan, 2007). Rath & al. (1991) affirment même que le tropilaelaps n’est pas un parasite spécifique du couvain des abeilles. Son anatomie généraliste lui permet de s’attacher à plusieurs sites sur l’hôte.
Reproduction et cycle de vie : un parasite qui se prend pour le varroa
Reproduction du tropilaelaps
Le processus de reproduction dans le couvain par le tropilaelaps est similaire à celui du varroa de manière générale, mais quelques différences rendent son parasitisme plus foudroyant. Une ou plusieurs femelles fondatrices entrent dans une cellule de couvain ouverte contenant une larve au quatrième stade (Burgett & al., 1983). T. mercedesae démarre la ponte plus rapidement que V. destructor (10 h contre 60 h pour le varroa). La raison serait que la fondatrice Tropilaelaps n’a pas besoin d’hémolymphe pour enclencher l’ovogénèse, contrairement au varroa (Woyke, 1994). Le rythme de ponte est également plus efficace, avec un œuf toutes les 24 heures (Woyke, 1987a), contre toutes les 30 heures pour le varroa. Plusieurs études s’accordent sur le sex-ratio d’environ un mâle (souvent le premier œuf pondu) pour quatre femelles (trois nouveaux individus femelles et la femelle fondatrice), dans une seule cellule de couvain, qui émergeront avec la nouvelle abeille (Woyke, 1987d, Rath & al., 1991). Cependant, des records ont pu être enregistrés dans du couvain abandonné. Le ratio était d’un pour huit (Kavinseksan, 2003). Des observations en Thaïlande ont montré qu’il était possible de trouver jusqu’à quatorze adultes et une dizaine de nymphes dans une seule cellule parasitée (jusqu’à 36 nymphes du parasite sur la même pupe d’abeille, en Inde (Atwal & Goyal, 1971). En Serbie, si l’acarien a été détecté, c’est en raison de la présence de 78 individus sur un seul bourdon (Manić & al., 2014). Une étude coréenne récente a montré que la prolificité des fondatrices était stimulée lorsqu’elles étaient plusieurs dans la même cellule, passant en moyenne de 1,6 progéniture par fondatrice, lorsque celle-ci occupe seule la cellule, à presque trois progénitures en moyenne, lorsqu’elles sont trois fondatrices dans la même cellule de couvain (Dongwon, 2016, cité par de Guzman & al., 2017). Il a été déterminé que les différents stades de développement de l’acarien Tropilaelaps sont (Kitprasert, 1984 ; Woyke, 1987b) :
- entre 0,5 et 1 jour d’œuf, la durée du stade œuf est peu documentée et semble souvent incluse dans la durée du stade larvaire,
- entre 0,5 et 2 jours pour les larves,
- environ 2 jours pour la protonymphe,
- environ 3 jours pour la deutonymphe.
Soit une durée de cycle de développement d’environ six à neuf jours (Woyke, 1987c ; Kumar & al., 1993b) (illustration 5). Le mâle Tropilaelaps semble avoir besoin d’environ 24 heures pour aboutir à son développement complet et s’accouple avec toutes les femelles vierges avant l’émergence de l’ouvrière (Rath & al., 1991).
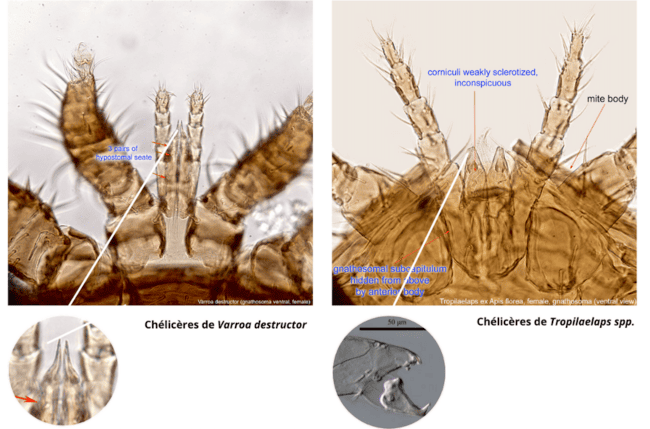
À gauche, les chélicères en pince du tropilaelaps pour déchirer les tissus mous (sources : photos du haut : https://idtools.org/bee
photo du bas : chélicère d’une femelle de l’acarien Tropilaelaps : Joharchi & Stolbova, 2024).
Le tropilaelaps est connu pour sa phase phorétique très courte. En l’absence de couvain, la durée de vie du tropilaelaps varie autour de deux jours, selon les études (Kitprasert, 1984 ; Woyke, 1984). Les nouvelles fondatrices, à peine émergées, cherchent immédiatement du couvain ouvert où retourner (Woyke, 1987b), tandis que les fondatrices V. destructor restent sur les hôtes adultes en moyenne treize jours avant de rentrer se reproduire (Schulz, 1984) et jusqu’à plusieurs mois lorsque le couvain est absent pendant l’hiver (Beetsma & al., 1999). C’est sur cette phase très courte que repose d’ailleurs un des moyens de lutte le plus efficace : l’interruption de couvain. Cependant, une étude a montré en conditions de laboratoire (chambre tempérée à 25°C), des individus capables de survivre plus de quatre jours (Wilde, 2001). En somme, en 25 jours, le tropilaelaps peut effectuer deux cycles complets, et en un cycle d’ouvrière toutes les nouvelles femelles, futures fondatrices, ont fini leur développement, ce qui n’est pas le cas du varroa pour qui, à l’émergence de l’ouvrière, toutes les nymphes varroa n’ont pas atteint la pleine maturité (Woyke, 1987d ; Woyke, 1987b). Une autre différence marquante entre les deux parasites est la capacité du tropilaelaps à la parthénogénèse deutérotoque (et non arrhénotoque comme le varroa). En effet, pour la première fois, dans une étude de 2018 (de Guzman & al., 2017), des femelles non accouplées ont été capables de pondre à la fois des mâles et des femelles (parthénogénèse deutérotoque), et se reproduire sans période de phorésie sur les abeilles adultes. La somme de ces différences avec le varroa expliquerait la prolifération plus rapide de l’acarien Tropilaelaps et les symptômes plus foudroyants, en présence de couvain permanent chez l’hôte. Au niveau de l’alimentation, le tropilaelaps est plus généraliste que le varroa. Il se nourrit principalement de l’hémolymphe (en raison de ses pièces buccales) contrairement au varroa qui se nourrit aussi de corps gras. Cela expliquerait probablement la phase phorétique très courte. Autre caractéristique plus grave : le tropilaelaps a plusieurs sites d’alimentation sur la même nymphe, contrairement au varroa qui n’a qu’un seul site. Ces nombreux points d’alimentation entrainent de sévères dommages, comme des nécroses et des malformations cicatricielles. Ils sont, de plus, des points d’entrée supplémentaires pour les pathogènes (Phokasem & al., 2019).
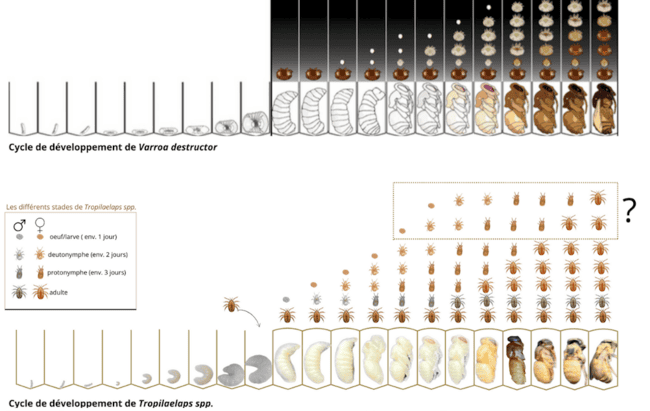
Cycles comparés de développement du varroa et du tropilaelaps, dans le couvain d’une ouvrière Apis mellifera. Le tropilaelaps est un acarien avec un cycle de développement semblable à celui du varroa : le premier oeuf pondu est un mâle, mais la fondatrice pond plus rapidement et est plus prolifique. En moyenne, une femelle du tropilaelaps produit quatre juvéniles, mais elle peut en avoir jusqu’à six avec un développement complet, à l’émergence de l’ouvrière (Source schéma varroa : McGruddy & al, 2024. Réalisation schéma Tropilaelaps : Camille Laurent).
Pathologie et moyens de lutte
Maladie et signes cliniques chez A. mellifera
Les signes cliniques sont très proches de ceux de la varroose. Les colonies hautement parasitées par l’acarien Tropilaelaps ont un couvain lacunaire, des cellules ouvertes avec des pupes partiellement mangées ou nettoyées (Woyke, 1984). Certaines nymphes d’abeilles mortes sont à un stade incomplet de nymphose et cela peut représenter jusqu’à 50 % du couvain dans une colonie fortement infestée (Atwal & Goyal, 1971), dans les climats les plus propices. Plusieurs virus ont été décelés et, pour l’instant, le tropilaelaps serait un vecteur avéré du DWV (Dainat & al., 2009 ; Khongphinitbunjong & al., 2015), et en Thaïlande du ABPV (Chanpanitkitchote, & al., 2018) La co-infestation par le varroa et le tropilaelaps est observée en Asie dès la découverte de ce dernier (Burgett & al., 1983). Le tropilaelaps s’est trouvé dix fois plus nombreux dans le couvain de colonies au sud du Vietnam (Woyke, 1987c). En Thaïlande, il est commun de trouver les deux parasites dans la même colonie d’A. mellifera, et le tropilaelaps est souvent en plus grand nombre (Burgett & al., 1983 ; Buawangpong & al., 2015).
Risques de propagation
La dispersion du parasite se fait, premièrement, par la voie naturelle, grâce à la phorésie des adultes lors de l’essaimage, de visites de mêmes ressources florales (Burgett et al., 1983 ; Woyke, 1984, Delfinado-Baker et Aggarwal, 1987), par pillage entre colonies de même espèce ou d’espèces différentes, ou encore par la dérive accidentelle d’abeilles et de faux-bourdons infestés (Laigo et Morse, 1968). Les changements climatiques modifieront les aires de distribution géographiques des hôtes actuels dans les années à venir. Les zones tempérées dans lesquelles A. mellifera peut produire du couvain tout au long de l’année pourraient s’étendre, à mesure que les régions froides deviennent plus chaudes, participant ainsi à la propagation du parasite (Le Conte et Navajas, 2008). Les activités humaines tiennent également une place importante dans la prolifération du parasite. En Afghanistan, dans les années 80, le déplacement des ruches dans des zones plus chaudes pour l’hivernage a été favorable au développement du tropilaelaps en l’absence d’interruption de couvain. La gestion des colonies par les apiculteurs, dans cette situation, a été un facteur aggravant. 90 % du cheptel d’Afghanistan, qui était exempt de varroa, a été décimé en 1983. Des essais ont démontré que les ruches infestées en juillet, mais hivernant au nord, près de Kaboul, n’ont plus de parasite au printemps suivant. L’interruption de couvain y est de deux mois, le tropilaelaps ne peut survivre dans ces conditions (Woyke, 1984). Si les apiculteurs sont souvent incriminés, à cause du commerce de reines et de paquets d’abeilles (de Guzman & al., 2017) ou de leurs pratiques apicoles, la globalisation du transport de marchandises n’est pas en reste. Des abeilles ouvrières A. dorsata ont déjà été retrouvées dans un aéroport international en Australie, dans des avions de fret arrivant de Malaisie. Ces abeilles étaient probablement des butineuses désorientées par les lumières de l’aéroport, et seraient restées bloquées sur une cargaison en chargement (Anderson & Roberts, 2013).
Dépistage
En cas de suspicion, et pour dépister le tropilaelaps, il faut procéder de la même manière que pour le varroa : chute naturelle sur carton collant, comptage des individus phorétiques sur les ouvrières, examen du couvain. En décapant le couvain operculé, la fondatrice et sa progéniture sont visibles à l’œil nu. La phase phorétique étant très courte, on les trouve peu sur les ouvrières adultes. Les méthodes de comptage au sucre-glace, à l’eau savonneuse ou à l’alcool, seraient donc moins pertinentes, mais fonctionnent tout de même (Anderson & Roberts, 2013). Pettis & al. (2013) proposent le « Bump-test » pour un dépistage à grande échelle, et sûr à 95 %, dans une région donnée. Ce test consiste, une fois les abeilles secouées, à frapper plusieurs fois, au-dessus d’un contenant, des cadres de couvain ouvert, et à compter les parasites sur les larves et les nymphes.
Traitements et moyens de lutte :
Beaucoup de molécules ont été testées et souvent dans un contexte asiatique et donc climatique différent du nôtre: le chlorobenzilate (Laigo & Morse, 1968 ; Atwal & Goyal, 1971), la Terramycine, le soufre (Atwal & Goyal, 1971 ; Garg & Sharma, 1988, Pettis & al., 2017), le fluvalinate (Lubinevski & al., 1988 ; Burgett & Kitprasert, 1990), le coumaphos et la fluméthrine (Kongpitak et al., 2008), l’acide formique, en fumigation (Garg & al., 1984) ou en pâton (Pettis & al., 2017 ; Madison & al., 2024), ou encore les huiles essentielles (Boonmee & al., 2022 ; Chaimanee & al., 2020). Tous ces traitements ne sont finalement que des adaptations des traitements contre le varroa, et beaucoup d’entre eux ont une efficacité limitée, car ils fonctionnent par contact ; or, les acariens Tropilaelaps se trouvent en bien moindre importance sur les abeilles adultes que dans le couvain (Ramsey, 2021). L’efficacité, notamment des produits volatils, peut différer selon la température et l’humidité. Actuellement, c’est l’acide formique qui semble être le traitement le plus efficace en Thaïlande, avec 98.78 % d’efficacité pour le Formic Pro et 94.88 % pour l’acide formique en solution (Madison & al., 2024). L’amitraze n’aurait aucun effet sur le parasite (Pettis & al., 2017), ce qui suggère que les acaricides contre le varroa ne sont pas tous efficaces contre le tropilaelaps. Concernant les moyens de lutte biomécanique, l’interruption de couvain, soit par encagement des reines (Woyke, 1985), soit par retrait de couvain (Van Dung & al. ,1997), donne de très bons résultats en raison de la difficulté du parasite à survivre plus de trois jours en phase phorétique. Woyke (1985) affirme même que priver simplement la colonie de tout couvain, soit par encagement, soit par retrait des cadres de couvain, suffit à lutter contre le parasite, sans traitement. Cela mériterait d’être testé à nouveau depuis la découverte d’une fondatrice Tropilaelaps se nourrissant sur des abeilles adultes (Anderson & Morgan, 2007). La division de la colonie pour la création d’essaims à partir de cadres de couvain infestés a, étonnamment, eu un impact positif sur la maîtrise des niveaux d’infestation des colonies-mères, comme des essaims (Pettis & al., 2017). Récemment, en Thaïlande, les pads (tapis) chauffants (heating pad, dispositif chauffant sous forme de tapis utilisé pour tuer les varroas. Il s’insère sur le plancher de la ruche et permet de monter la température intérieure à 41°C en 2h30) ont montré des résultats plus graduels dans le temps, mais efficaces par rapport aux témoins (réduction, en trois semaines, de 92,3 % de parasites vivants) (Madison & al., 2024).
Conclusion
En somme, l’acarien Tropilaelaps est un parasite au fonctionnement et au comportement semblables à ceux du varroa, mais avec une infestation ressentie de façon plus foudroyante sur Apis mellifera. Son cycle plus rapide, sa fécondité plus grande, et sa capacité à mieux s’insérer entre les segments des abeilles, et donc à mieux se prémunir du toilettage, en font une menace très inquiétante. Il se définit avec « un répertoire comportemental simplifié dans un environnement sombre et stable, reflétant un cycle de vie qui se déroule principalement à l’intérieur de la cellule de couvain de l’abeille mellifère » (Dong & al., 2017). Les moyens de lutte se concentrent essentiellement sur le couvain. Les effets négatifs du tropilaelaps sur la santé des colonies s’ajouteront à ceux du varroa. La gestion du parasite se fera avec les mêmes moyens de lutte que ceux utilisés pour lutter contre le varroa. Ce parasite est très sensible à l’interruption de couvain, sa phase phorétique n’étant que de quelques dizaines d’heures. À l’échelle d’une exploitation, une infestation serait très dommageable au regard de la vitesse d’expansion de la maladie et des dégâts sur les colonies. De plus, hiverner des colonies malades et très affaiblies, même si le parasite a disparu, pourrait entrainer des pertes hivernales importantes, avec des conséquences économiques pour la filière. Y a-t-il d’autres hôtes lui permettant de survivre à proximité des ruches ? A-t-il réussi à allonger sa phase phorétique, comme pourraient le laisser supposer ces femelles beaucoup plus grosses observées avant l’hiver en Russie ? Ce sont les questions qui sont posées dans l’article de 2024 cité en introduction. Nous manquons indéniablement de connaissances sur cet acarien en contexte septentrional, notamment sur sa capacité à passer l’hiver.
Remerciements
Je tiens à remercier chaleureusement le Pr Pierre Giovenazzo, pour m’avoir intégrée dans son équipe de recherche, et pour m’avoir suggéré d’étudier la littérature concernant ce sujet porteur de sérieuses inquiétudes pour l’avenir de notre apiculture.
(1) Signification de spp. Sp. Quand on fait référence à une espèce non déterminée (non identifiée) mais dont le genre est connu, il est d’usage d’utiliser les abréviations de sp. (singulier) ou spp. (pluriel), immédiatement à la suite du nom de genre (source Inrae).
(2) Professionnelle de recherche, Laboratoire de Pierre Giovenazzo, Département de biologie Université Laval.
Pour vous abonner à la revue Info-Reines cliquez ici
Pour vous former aux techniques d’élevage de reines – catalogue formations
RÉFÉRENCES
- L. Anderson & M. J. Morgan (2007). Genetic and morphological variation of bee-parasitic Tropilaelaps mites (Acari : Laelapidae) : new and re-defined species. Experimental and Applied Acarology, vol.43(1), p.1-24. https://doi.org/10.1007/s10493-007-9103-0
- L. Anderson & J. M. K Roberts (2013). Standard methods for Tropilaelaps mites research. Journal of Apicultural Research, vol.52(4), p.1-16. http://dx.doi.org/10.3896/IBRA.1.52.4.21
- S. Atwal, & N. P. Goyal, (1971). Infestation of Honeybee Colonies with Tropilaelaps, and its Control. Journal of Apicultural Research, vol.10(3), p.137-142. https://doi.org/10.1080/00218839.1971.11099686
- Beetsma, W. J. Boot, & J. Calis, (1999). Invasion behaviour of Varroa jacobsoni Oud. : From bees into brood cells. Apidologie, vol.30, p125-140.
- Boonmee, L. Wongthaveethong, C. Sinpoo, T. Disayathanoowat, J. S. Pettis & V. Chaimanee (2022). Surface Modification of Materials by Atmospheric-Pressure Plasma to Improve Impregnation with Essential Oils for the Control of Tropilaelaps Mites in Honeybees (Apis mellifera). Applied Sciences, vol.12(12). https://doi.org/10.3390/app12125800
- Brandorf, M. M. Ivoilova, O. Yañez, P. Neumann & V. Soroker (2024). First report of established mite populations, Tropilaelaps mercedesae, in Europe. Journal of Apicultural Research, 13. https://doi.org/10.1080/00218839.2024.2343976
- Buawangpong, L. I. de Guzman, K. Khongphinitbunjong, A. M. Frake, M. Burgett & P. Chantawannakul (2015). Prevalence and reproduction of Tropilaelaps mercedesae and Varroa destructor in concurrently infested Apis mellifera colonies. Apidologie, vol.46(6), p.779-786. https://doi.org/10.1007/s13592-015-0368-8
- M. Burgett, & C. Kitprasert (1990). Evaluation of Apistan as a control for Tropilaelaps clareae (Acari : Laelapidae), an Asian honey bee brood mite parasite. American Bee Journal, vol.130(1), p51-53.
- Burgett, P. Akratanakul & R. A. Morse (1983). Tropilaelaps Clareae : A Parasite of Honeybees in South-East Asia. Bee World, vol.64(1), p.25-28. https://doi.org/10.1080/0005772X.1983.11097904
- Burgett, P. Rossignol & C. Kitprasert (1990). A model of dispersion and regulation of brood mite (Tropilaelaps clareae) parasitism on the giant honeybee (Apis dorsata). Canadian Journal of Zoology, vol.68, p.1423-1427. https://doi.org/10.1139/z90-212
- Chaimanee, N. Warrit, T. Boonmee & J. S. Pettis (2021). Acaricidal activity of essential oils for the control of honeybee (Apis mellifera) mites Tropilaelaps mercedesae under laboratory and colony conditions. Apidologie, vol.52(3), p.561-575. https://doi.org/10.1007/s13592-021-00843-z
- Chanpanitkitchote, Y. Chen, J. D. Evans, W. Li, J. Li, M. Hamilton & P. Chantawannakul (2018). Acute bee paralysis virus occurs in the Asian honey bee Apis cerana and parasitic mite Tropilaelaps mercedesae. Journal of Invertebrate Pathology, vol.151, p.131-136. https://doi.org/10.1016/j.jip.2017.11.009
- Dainat, T. Ken, H. Berthoud & P. Neumann (2009). The ectoparasitic mite Tropilaelaps mercedesae (Acari, Laelapidae) as a vector of honeybee viruses. Insectes Sociaux, vol.56(1), p.40-43. https://doi.org/10.1007/s00040-008-1030-5
- I. de Guzman, G. R. Williams, K. Khongphinitbunjong & P. Chantawannakul (2017). Ecology, Life History, and Management of Tropilaelaps Mites. Journal of Economic Entomology, vol.110(2), p.319-332. https://doi.org/10.1093/jee/tow304
- D. Delfinado & E. W. Baker (1961). Tropiladaps, a new genus of mite from the Philippines (Laelaptidae [s. Lat.] : Acarina). Fieldiana, vol.44, p.53-56.
- Delfinado-Baker & K. Aggarwal (1987). Infestation of Tropilaelaps clareae and Varroa jacobsoni in Apis mellifera ligustica colonies in Papua New Guinea. American Bee Journal, vol.127(6), p.443.
- Delfinado-Baker & E. Baker (1982). A new species of Tropilaelaps parasitic on honey bees. American Bee Journal, vol.122(6), p.416-417. CABI Databases.
- Dong, S. D. Armstrong, D. Xia, B. L. Makepeace, A. C. Darby & T. Kadowaki (2017). Draft genome of the honey bee ectoparasitic mite, Tropilaelaps mercedesae, is shaped by the parasitic life history. GigaScience, vol.6(3), gix008. https://doi.org/10.1093/gigascience/gix008
- Garg, O. P. Sharma & G. S. Dogra (1984). Formic acid : An effective acaricide against Tropilaelaps clareae Delfinado and Baker (Laelaptidae : Acarina) and its effect on the brood and longevity of honey bees. American Bee Journal, vol.124(10), p.736-738.
- A. Griffiths (1988). Functional morphology of the mouthparts of Varroa jacobsoni and Tropilaelaps clareae as a basis for the interpretation of their life-styles. Africanized honey bees and bee mites, p.479-486.
- Han, J. Wu, Q. Wei, Q., F. Liu, L. Cui, O. Rueppell & S. Xu (2024). Life-history stage determines the diet of ectoparasitic mites on their honey bee hosts. Nature Communications, vol.15(1), art.725. https://doi.org/10.1038/s41467-024-44915-x
- Janashia, A. Uzunov, C. Chen, C. Costa & C. Giovanni (2024) « First Report on Tropilaelaps mercedesae Presence in Georgia: The Mite is Heading Westward! » Journal of Apicultural Science, vol.68 n° 2. https://doi.org/10.2478/jas-2024-0010
- Joharchi & V. Stolbova (2024). The first report on the ectoparasitic genus Tropilaelaps (Acari : Mesostigmata : Laelapidae) in Russia.
- Kavinseksan, S. Wongsiri, L. I. de Guzman & T. E. Rinderer (2003). Absence of Tropilaelaps infestation from recent swarms of Apis dorsata in Thailand. Journal of Apicultural Research, vol.42(3), p.49-50. https://doi.org/10.1080/00218839.2003.11101091
- Khongphinitbunjong, L. I. de Guzman, M. R. Tarver, T. E. Rinderer & P. Chantawannakul, (2015). Interactions of Tropilaelaps mercedesae, honey bee viruses and immune response in Apis mellifera. Journal of Apicultural Research, vol.54(1), P.40-47. https://doi.org/10.1080/00218839.2015.1041311
- Kitprasert (1984). Biology and systematics of the parasitic bee mite, Tropilaelaps clareae Delfinado and Baker (Acarina : Laelapidae).
- Koeniger & N. Muzaffar (1988). Lifespan of the Parasitic Honeybee Mite, Tropilaelaps clareae, on Apis cerana, dorsata and mellifera. Journal of Apicultural Research, vol.27(4), p.207-212.
- Kongpitak, G. Polgár & J. Heine (s. d.). The Efficacy of Bayvarol ® and CheckMite+ ® in the Control of Tropilaelaps mercedesae in the European Honey Bee ( Apis mellifera ) in Thailand.
- M. Laigo & R. A. Morse (1968). The mite Tropilaelaps clareae in Apis dorsata colonies in the Philippines. Bee World, vol.49(3), p.116-118. https://doi.org/10.1080/0005772X.1968.11097211
- Le Conte & M. Navajas (2008). Climate change : impact on honey bee populations and diseases. Revue scientifique et technique (International Office of Epizootics), vol.27, p.485-497, 499-510.
- Lubinevski, Y. Stern, Y. Slabezki, Y. Lensky, H. Ben-Yossef & U. Gerson (1988). Control of Varroa jacobsoni and Tropilaelaps clareae mites using Mavrik in A. mellifera colonies under subtropical and tropical climates. American Bee Journal, vol.128(1), p.48-51.
- Madison Sankovitz, N. Steinhauer, T. Yemor, S. C. Cook, J. D. Evans & S. D. Ramsey (2024). Evaluation of efficacy of formic acid and thermal remediation for management of Tropilaelaps and Varroa mites in central Thailand. bioRxiv. Publicly Available Content Database. https://doi.org/10.1101/2024.03.04.582002
- Manić, B. Djuricic & Z. Raicevic (2014). Tropilaelaps of bees—Epizootiological picture with special emphasis on the first description of the parasite in bumblebees and bees in Serbia. Veterinarski glasnik, vol.68, p.371-378. https://doi.org/10.2298/VETGL1406371M
- A. McGruddy, Z. Smeele, B. Manley, J. Masucci, J. Haywood & P. Lester (2024). RNA interference as a next‐generation control method for suppressing Varroa destructor reproduction in honey bee (Apis mellifera) hives. Pest Management Science, vol.80(9) p.4770-4778. https://doi.org/10.1002/ps.8193
- S. Michael (1962). Tropilaelaps Clareae, a Mite Infesting Honeybee Colonies. Bee World, vol.43(3), p.81-82. https://doi.org/10.1080/0005772X.1962.11096944
- S. Pettis, R. Rose & V. Chaimanee (2017). Chemical and cultural control of Tropilaelaps mercedesae mites in honeybee (Apis mellifera) colonies in Northern Thailand. PLOS ONE, vol.12(11), e0188063. https://doi.org/10.1371/journal.pone.0188063
- S. Pettis, R. Rose, E. M. Lichtenberg, P. Chantawannakul, N. Buawangpong, W. Somana, P. Sukumalanand & D.Vanengelsdorp (2013). A Rapid Survey Technique for Tropilaelaps Mite (Mesostigmata : Laelapidae) Detection. Journal of Economic Entomology, vol.106(4), p.1535-1544. https://doi.org/10.1603/EC12339
- Phokasem, L. I. de Guzman, K. Khongphinitbunjong, A. M. Frake & P. Chantawannakul (2019). Feeding by Tropilaelaps mercedesae on pre- and post-capped brood increases damage to Apis mellifera colonies. Scientific Reports, vol.9(1), n°13044. https://doi.org/10.1038/s41598-019-49662-4
- D. Ramsey (2021). Foreign Pests as Potential Threats to North American Apiculture : Tropilaelaps mercedesae, Euvarroa spp., Vespa mandarinia, and Vespa velutina. Honey Bee Veterinary Medicine, vol.37(3), p.545-558. https://doi.org/10.1016/j.cvfa.2021.06.010
- Rath, M. Delfinado-Baker & W. Drescher (1991). Observations on the mating behavior, sex ratio, phoresy and dispersal of Tropilaelaps clareae (Acari : Laelapidae). International Journal of Acarology, vol.17(3), p.201-208. https://doi.org/10.1080/01647959108683907
- B. Rašović (2019). Importance and measures of the protection of honey bees from tropilelosis (with a special focus on montenegro). https://www.cabidigitallibrary.org/doi/pdf/10.5555/20203177483
- Ritter & U. Schneider-Ritter (1988). Differences in biology and means of controlling Varroa jacobsoni and Tropilaelaps clareae, two novel parasitic mites of Apis mellifera. P.387-395.
- E. Schulz (1984). Reproduktion und populationsentwicklung der parasitischen milbe varroa jacobsoni Oud. In abhängigkeit vom brutzyklus ihres wirtes Apis mellifera l. (i. Teil). Apidologie, vol.15(4), p.401-420.
- Van Dung, N. Quang Tan, L. Van Huan & W. J. Boot (1997). Control of honey bee mites in Vietnam without the use of chemicals. Bee World, vol.78(2), p.78-83. https://doi.org/10.1080/0005772X.1997.11099338
- Wilde (2001). How long can Tropilealaps clareae survive on adult honeybee workers ? Proceedings euroconference on molecular mechanisms of disease tolerance in honeybees (MOMEDITO). 17-19.10.2000. Kralupy near Prague : 217-221.
- Woyke (1987). Length of Successive Stages in the Development of the Mite Tropilaelaps Clareae in Relation to Honeybee Brood Age. Journal of Apicultural Research, vol.26(2), p.110-114. https://doi.org/10.1080/00218839.1987.11100746
- Woyke b, J. (1987). Length of Stay of the Parasitic Mite Tropilaelaps Clareae Outside Sealed Honeybee Brood Cells as a Basis for its Effective Control. Journal of Apicultural Research, 26(2), 104109. https://doi.org/10.1080/00218839.1987.11100745
- Woyke (1987). Infestation of Honeybee (Apis Mellifera) Colonies by the Parasitic Mites Varroa Jacobsoni and Tropilaelaps Clareae in South Vietnam and Results of Chemical Treatment. Journal of Apicultural Research, vol.26(1), p.64-67. https://doi.org/10.1080/00218839.1987.11100738
- Woyke (1987). Comparative Population Dynamics of Tropilaelaps Clareae and Varroa Jacobsoni Mites on Honeybees. Journal of Apicultural Research, vol.26(3), p.196-202. https://doi.org/10.1080/00218839.1987.11100759
- Woyke (1984). Survival and prophylactic control of Tropilaelaps clareae infesting Apis mellifera colonies in Afghanistan. Apidologie, vol.15(4), p.421-434.
- Woyke (1985). Further Investigations into Control of the Parasite Bee Mite Tropilaelaps Clareae without Medication. Journal of Apicultural Research, vol.24(4), p.250-254. https://doi.org/10.1080/00218839.1985.11100681
- Woyke (1994). Tropilaelaps clareae females can survive for four weeks when given open bee brood of Apis mellifera. Journal of Apicultural Research, vol.33(1), p.21-25. https://doi.org/10.1080/00218839.1994.11100845
PARTAGEZ CET ARTICLE
ARTICLES RÉCENTS


« L’apiculture française en mutation : vers des apicultures au pluriel » – Vidéo



